Come si forma una blastocisti?
Analizziamo il processo di formazione di una blastocisti. La fecondazione della cellula uovo da parte dello spermatozoo è un processo biologico che si verifica all’interno delle tube a seguito del rilascio del gamete femminile dal follicolo (l’ovulazione). Lo zigote così formato, all’interno delle stesse tube, va incontro ad una serie di divisioni cellulari sino alla quarta giornata post-fecondazione. A questo stadio, l’embrione generatosi, che prende il nome di “morula” e che risulta composto da un numero di cellule che varia, mediamente, da 16 a 32, raggiunge la sede dell’eventuale impianto, la cavità uterina.
All’interno dell’utero, tra la quinta e la settima giornata post-fecondazione, l’embrione si dota di una cavità liquida (il “blastocele”) e le cellule che compongono l’embrione iniziano il primo processo differenziativo che porta alla formazione di due linee cellulari funzionalmente indipendenti: le cellule del trofoectoderma (o trofoblasto) che daranno vita agli annessi embrionali; le cellule della “massa interna” responsabili della formazione del feto.
L’embrione, che a questo stadio è chiamato “blastocisti”, si espande progressivamente fino a fuoriuscire dal guscio protettivo di cui era dotato per alloggiarsi e successivamente attaccarsi (tecnicamente questo processo è noto come “impianto” dell’embrione) a livello dell’endometrio.

Che vantaggi offre eseguire il transfer a blastocisti?
Nel campo della Medicina della Riproduzione, il “ripasso” degli eventi descritti lascia intravedere i principali vantaggi ottenibili dall’eseguire il trasferimento embrionale allo stadio di blastocisti:
- il trasferimento embrionale avviene al momento del naturale ingresso nell’utero dell’embrione che, di conseguenza, trova le migliori condizioni ambientali;
- l’embrione o gli embrioni trasferiti sono dotati, statisticamente, di probabilità di impianto maggiori dal momento che “resistono” alla selezione naturale dovuta al protrarsi del periodo di coltura ex-vivo;
- è possibile ridurre il numero di embrioni da trasferire in utero mantenendo elevata la percentuale di ottenere una gravidanza (per la considerazione cui si rimanda al punto precedente) e riducendo, contemporaneamente, i rischi connessi all’insorgenza di gravidanze multiple.
Oggi, il miglioramento nella formulazione chimica e il corretto e sapiente utilizzo dei terreni di coltura impiegati per lo sviluppo embrionale in-vitro hanno fatto in modo che una percentuale sempre crescente di embrioni sia in grado di raggiungere lo stadio di blastocisti per poi essere trasferiti in cavità uterina.
Inoltre, oltre all’implementazione dei terreni di coltura, affinché le condizioni fisiologiche che l’embrione incontra all’interno del tratto riproduttivo femminile possano essere riprodotte quanto più “fedelmente” possibile all’interno di un laboratorio, sono stati generati incubatori in grado di fornire la miscela gassosa idonea per un corretto sviluppo embrionale.
L’esperienza Alma Res
Grazie a tali progressi tecnico-scientifici presso il nostro Centro di Fecondazione Assistita, da sempre votato alla ricerca scientifica e tradizionalmente attento alle innovazioni tecnologiche fornite dagli specialisti del settore, la percentuale di blastocisti ottenute (calcolata sugli embrioni presenti in coltura in quinta/sesta giornata post-fecondazione) supera il 60%, indipendentemente dal fattore età materna e dalla condizione di infertilità.
Tuttavia, nonostante i progressi tecnico-scientifici realizzatisi nell’ambito della Medicina e Biologia della riproduzione, è “alquanto” difficile ricreare quelle condizioni che, in natura, garantiscono che un embrione arrivi allo stadio di blastocisti e si impianti in utero. Per questo l’equipe medica e quella biologica valuteranno insieme se effettuareil trasferimento in utero allo stadio di blastocisti, ovvero in quinta giornata di sviluppo, o se anticipare il trasferimento alla terza giornata di sviluppo embrionale.
Come avviene l’impianto?
Come descritto, l’impianto è quel processo che consente alla blastocisti di alloggiarsi e successivamente “annidarsi” nell’endometrio materno, per trarre da questo nutrimento e protezione.
È possibile schematizzare l’impianto embrionale in tre fasi ben distinte:
- Apposizione: l’embrione si appoggia all’endometrio, accostandosi a una zona specifica;
- Adesione: l’embrione deve riuscire a creare dei legami più forti con l’endometrio, deve “agganciarsi”;
- Invasione: l’embrione emette dei prolungamenti che penetrano nell’endometrio, raggiungendo i vasi uterini.
In tutto questo periodo, sia l’embrione sia l’endometrio esercitano un ruolo attivo, comunicando tra loro attraverso la secrezione di diversi mediatori chimici. Il successo di questo complesso processo, che porta all’istaurarsi della gravidanza, dipende da numerosi fattori, correlati principalmente con la qualità dell’embrione e con la recettività dell’endometrio. Si stima che il 30-50% delle mancate gravidanze sia da attribuire ai fallimenti d’impianto.
In che modo è possibile aumentare le probabilità d’impianto di una blastocisti?
L’impianto dell’embrione è un processo estremamente complesso, oggi conosciuto solo in parte, che dipende non solo dalla qualità embrionaria, ma anche dalla ricettività endometriale e dalla sincronizzazione di entrambe. A seconda dei casi, sarà quindi possibile intervenire su uno od entrambi per aumentare le probabilità d’impianto di una blastocisti.
Assisted zona hatching
Come accennato in precedenza, ovociti ed embrioni nelle prime fasi di sviluppo sono circondati da un rivestimento acellulare, definito zona pellucida, la cui funzione si esplica sia durante la fecondazione (impedisce la polispermia ovvero penetrazione dell’ovocita da parte di più spermatozoi) sia al termine della stessa, quandofacilita il trasporto attraverso le tube degli ovociti fecondati e ne impedisce la dispersione dei blastomeri (le prime cellule che compongono gli embrioni) così come il contatto con gli elementi cellulari che possono minarne l’integrità. Quando l’embrione raggiunge lo stato di blastocisti l’espansione della massa embrionale determina l’assottigliamento, fino alla rottura, della zona pellucidarequisito fondamentale per l’interazione con l’endometrio e l’impianto dell’embrione.
Tuttavia, a volte in vitro questo processo non si compie correttamente per la presenza di una zona pellucida particolarmente spessa e di maggior consistenza.
Per superare tale ostacolo può essere effettuata una tecnica nota come “hatching assistito”, ovvero una distruzione artificiale della zona pellucida, eseguita prima del transfer in utero dell’embrione allo stato di blastocisti. Sono state proposte numerose tecniche di dissezione parziale con creazione di un varco o assottigliamentodella zona pellucida; oggi la più diffusa prevede l’impiego di un laser.
È fondamentale che la procedura venga eseguita da biologi esperti per evitare il potenziale danno termico, secondario all’impiego della tecnologia laser, minimizzare il tempo di permanenza degli embrioni al di fuori dell’incubatore ed ottimizzare la metodologia per ridurre le variazioni di pH e temperatura che possono inficiare lo sviluppo dell’embrione.
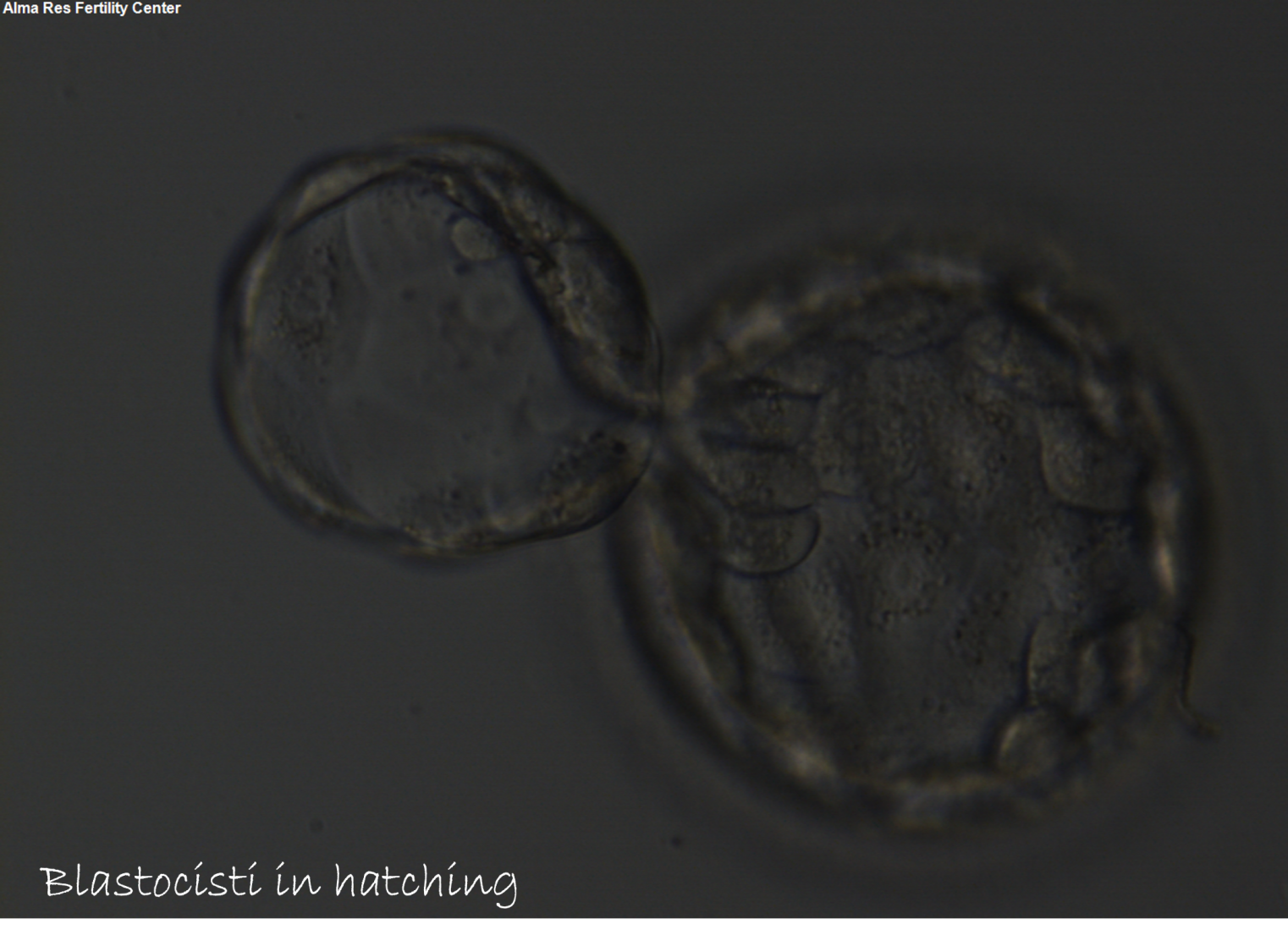
Quando è consigliato eseguire l’hatching assistito?
Sebbene il potenziale effetto dell’hatching assistito sulla percentuale di impianto e di gravidanza sia ancora oggetto di studio è noto come tale procedura debba essere eseguita in casi selezionati. Questi sono rappresentati dalla presenza di una zona pellucida particolarmente spessa e soprattutto in condizioni cliniche quali:
- donne di età superiore a 37 anni;
- donne con ridotta riserva ovarica (FSH basale elevato, basso AMH e ridotto numero di follicoli antrali al conteggio ecografico);
- ripetuti fallimenti dopo tre o più transfer embrionari;
- dopo ripetuti cicli di fecondazione in cui gli embrioni presentano scarsa qualità (divisione cellulare molto lenta o con eccessiva frammentazione).
Quando l’hatching assistito viene impiegato nelle condizioni sopraindicate è possibile osservare un incremento delle percentuali di gravidanza. Ciò è dovuto presumibilmente ad una più elevata capacità di impianto embrionale.
Test genetici pre-impianto (PGT)
I test genetici pre-impiantoconsentono di individuare eventuali patologie cromosomiche e/o malattie geniche negli embrioni. Tali anomalie genetiche possono causare fallimenti nell’impianto, aborti spontanei o problemi congeniti.
Questi test permettono ad embriologi e clinici di verificare l’assetto genetico di ogni embrione prima del suo trasferimento in utero. Con la semplice osservazione microscopica, infatti, non sarebbe possibile effettuare una completa valutazione dello stato di salute degli embrioni.
Quando è consigliato eseguire la diagnosi genetica pre-impianto e che tipo di test eseguire?
Tutte le coppie possono produrre embrioni con un assetto cromosomico definito “anomalo”. Tali anomalie possono essere numeriche (un cromosoma in più o in meno) o strutturali.
L’origine delle anomalie numeriche (aneuploidie) può essere dovuta sia alla presenza di un gamete (ovocita o spermatozoo) con assetto cromosomico anomalo, sia ad un errore nelle divisioni cellulari successive alla fecondazione. Esistono inoltre, categorie di pazienti a rischio in cui la probabilità di aneuploidia è significativamente maggiore, tra queste ricordiamo:
- donne con età superiore ai 35 anni;
- le pazienti con un’anamnesi di aborto spontaneo ricorrente o con ripetuti fallimenti d’impianto;
- uomini che presentano un deficit importante nei parametri del liquido seminale.
In tutti questi casi, trova indicazione il Test Genetico Pre-impianto per le Aneuploidie (PGT-A). Si tratta di uno screening dell’intero corredo cromosomico dell’embrione, che consente di identificare le eventuali copie in più o in meno di tutti i cromosomi, o la presenza di alterazioni cromosomiche di grandi dimensioni.
Ai pazienti portatori di anomalie strutturali (traslocazioni o inversioni), invece viene consigliato Il Test Genetico Pre-impianto per i riarrangiamenti sbilanciati (PGT-SR). Un portatore di tali anomalie normalmente non presenta problemi clinici, ma può talvolta avere difficoltà a concepire, ricorrenti fallimenti d’impianto e/o aumentata abortività.
Infine, Il test genetico pre- impianto per le malattie monogeniche (PGT-M) viene utilizzato per analizzare gli embrioni per una specifica malattia genetica prima del loro trasferimento in utero.Il principale vantaggio di eseguire il PGT-M consiste nel dare alla coppia, in cui uno od entrambi i partner sono affetti o portatori di una malattia genetica, la possibilità di avere un bambino sano per la malattia genetica indagata.
Quando si parla di fallimento ricorrente dell’impianto?
Si definisce fallimento ricorrente dell’impianto l’assenza di annidamento dopo due tentativi di trasferimento di embrioni di buona qualità allo stadio di blastocisti e con uno sviluppo embrionario appropriato. Una delle sfide più importanti nell’ambito della procreazione medicalmente assistita è rappresentata dalla ricerca delle cause di mancato impianto embrionario. Queste, come detto più volte, sono molteplici e di varia natura (fattori materni immunologici, endometriali, ambientali, genetici, fattori paterni).
E’ possibile esaminare la morfologia endometriale mediante una semplice ecografia pelvica transvaginale che ne studia la struttura e l’ecogenicità. Inoltre, le ultime ricerche scientifiche si sono soffermate sulla valutazione della flora batterica endometriale (microbioma) e della cosiddetta “finestra di impianto”, ovvero il periodo di ricettività endometriale opportuno per eseguire il corretto transfer dell’embrione in utero.
Questi due elementi oggi ci permettono uno studio più completo del pattern endometriale. Ci consentono inoltre di programmare il transfer embrionario nel momento più idoneo in base alle caratteristiche endometriali della paziente.
Scopri quali esami è possibile eseguire per lo studio del fattore endometriale materno. CLICCA QUI
Il trasferimento dell’embrione
Il trasferimento embrionale in utero è l’ultimo passaggio clinico-biologico di tutte le tecniche di procreazione medicalmente assistita (PMA) di 2° livello. Esso deve essere eseguito nel modo meno traumatico e nel tempo più breve possibile. Questo per evitare che gli embrioni possano essere danneggiati in modo irreversibile dallo shock termico e/o biologico.
Il trasferimento dell’embrione è eseguito dopo tre giorni (embrione a otto cellule) o dopo 5-6 giorni (blastocisti) dal prelievo ovocitario. Allo stadio di blastocisti ci troviamo nella fase, dove in natura l’embrione arriva nella cavità uterina e dovrà necessariamente impiantarsi per sopravvivere.
_______________________________________________________________________________________________________________________________________
SCOPRI
Il nostro staff: CLICCA QUI
Le nostre storie: CLICCA QUI
Le tecniche di PMA: CLICCA QUI
Leggi anche
Esiste una dieta specifica per aumentare le possibilità di gravidanza?: CLICCA QUI
Fertilità: un pratico vademecum di 10 Consigli per tenerla sotto controllo: CLICCA QUI
Diagnosi di infertilità: gli esami da fare: CLICCA QUI
Ringiovanimento Ovarico: aspettative e realtà: CLICCA QUI
Rimani sempre aggiornato, seguici su ![]()