Oggi, le metodiche di procreazione medicalmente assistita (PMA) comprendono una gamma di opzioni terapeutiche, a diverso grado di invasività, volte a risolvere molte forme differenti di infertilità. Tali metodiche nel nostro Paese sono state suddivise, tenendo conto della loro complessità e necessità o meno di anestesia, in tecniche di I, II e III livello.
Tecniche di I livello, prevedono un concepimento “in vivo”
- stimolazioni;
- inseminazione intrauterina.
Tecniche di II livello, prevedono il prelievo degli ovociti
- FIVET;
- ICSI;
- crioconservazione di ovociti ed embrioni;
- prelievo percutaneo di spermatozoi dal testicolo.
Tecniche di III livello prevedono una laparoscopia
- GIFT prevede di trasferire i gameti o gli embrioni all’interno delle tube;
- ZIFT prevede di trasferire i gameti o gli embrioni all’interno delle tube;
- TET prevede di trasferire i gameti o gli embrioni all’interno delle tube.
Le tecniche di III livello, oggi, sono utilizzate sempre più raramente, in quanto offrono percentuali di successo simili alla FIVET (tecnica che non richiede l’intervento laparoscopico) o un prelievo chirurgico di spermatozoi dal testicolo.
Stimolazione ovarica
Rappresenta spesso il primo approccio terapeutico nei casi di infertilità idiopatica di breve durata (inferiore ai 2 anni). Consiste in una blanda stimolazione ovarica, associata ad una valutazione ecografica dell’imminente ovulazione per programmare i cosiddetti rapporti mirati. Non è consigliabile eseguire più di 2-3 cicli, dopo i quali è corretto procedere con l’inseminazione intrauterina (IUI).
L’inseminazione artificiale
Comprende una varietà di procedure riguardanti il posizionamento dei gameti maschili, adeguatamente trattati, nell’apparato genitale femminile in modo tale da facilitare l’interazione spermatozoo-ovocita e la fecondazione dell’ovocita nel corpo della donna, senza che ci sia stato un rapporto sessuale. La tecnica prevede il monitoraggio ecografico ed ormonale della crescita follicolare durante un ciclo spontaneo o in corso di terapia ormonale di induzione dell’attività ovarica; l’induzione dell’ovulazione con gonadotropina corionica umana (hCG) quando il follicolo dominante (ciclo spontaneo) o due/tre follicoli (terapia ormonale di induzione dell’attività ovarica con gonadotropine o clomifene citrato) hanno raggiunto le dimensioni di circa 18 mm.
Dopo circa 36-40 ore dall’induzione dell’ovulazione si deposita nella cavità uterina, mediante una sottile cannula, una modesta quantità (0,3–0,5 ml) di liquido seminale adeguatamente trattato. L’obbiettivo dell’inseminazione intrauterina è quello di aumentare il numero di spermatozoi nel sito della fecondazione superando eventuali problemi legati al “filtro meccanico” esercitato dal muco cervicale e ottimizzando il “timing” dell’incontro degli ovociti con gli spermatozoi.
Fertilizzazione “In Vitro” e Trasferimento in utero di Embrioni (FIVET)
La FIVET è stata la prima metodica di concepimento assistito messa a punto per la coppia sterile. Per alcuni anni, questa tecnica è stata sinonimo del trattamento stesso di fecondazione “in vitro”. Oggi identifica un tipo di inseminazione che viene utilizzato per la fertilizzazione, da distinguersi dalla ICSI.
Le tappe fondamentali della FIVET consistono in una stimolazione ormonale (-consulta il focus sulla stimolazione ormonale e l’induzione della crescita follicolare multipla-) per indurre la crescita di più follicoli seguita dal prelievo degli ovociti. In seguito al prelievo, gli ovociti vengono mantenuti in coltura all’interno di appositi incubatori che garantiscono le condizioni ideali (Temperatura, CO2, Ph, Umidità) per la loro sopravvivenza. L’inseminazione viene eseguita mettendo a contatto, in una piccola quantità di terreno di coltura, ciascun ovocita prelevato con un certo numero di spermatozoi, preventivamente trattati, in modo da selezionare la frazione di spermatozoi mobili e morfologicamente normali. Le varie tappe della fecondazione (superamento delle barriere dell’ovocita, fusione con la membrana plasmatica e penetrazione all’interno dell’ovocita) avvengono spontaneamente, seppur in condizioni “in vitro”.
Per poter ottenere un’elevata percentuale di fecondazione è necessario potere selezionare dall’eiaculato un numero sufficiente di spermatozoi mobili. La FIVET può quindi essere utilizzata solo quando il liquido seminale presenta parametri normali o lievemente alterati.

Iniezione Intracitoplasmatica dello spermatozoo (ICSI)
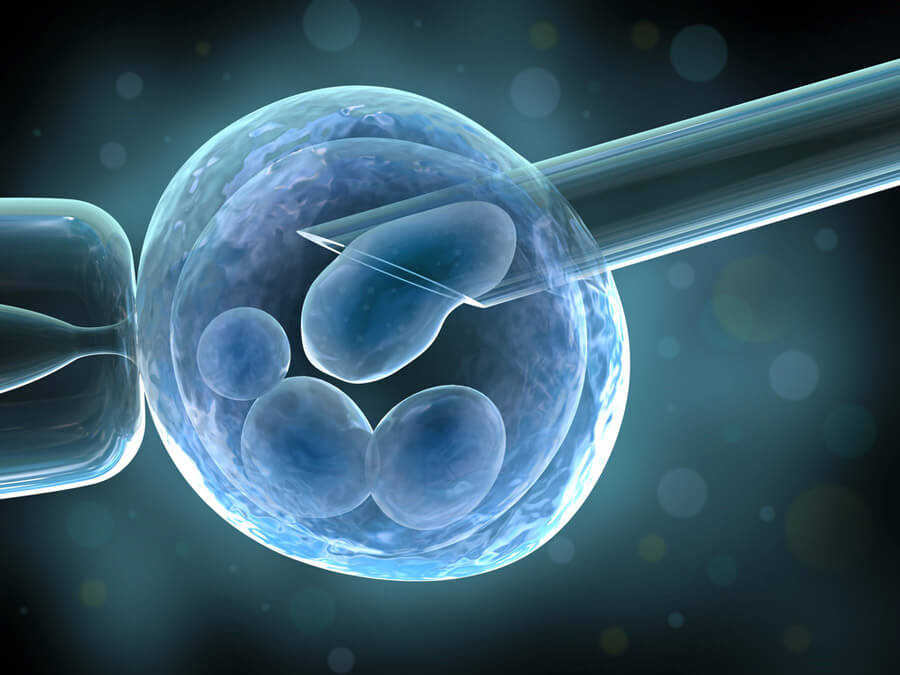
I campioni di liquido seminale con un basso numero e/o mobilità di spermatozoi non sono in grado di fecondare gli ovociti neppure “in vitro”. Le tecniche di microiniezione hanno rappresentato un’importante conquista in quanto permettono di ottenere una fecondazione “in vitro” anche in presenza di liquidi seminali con parametri estremamente scarsi, cioè con un bassissimo numero di spermatozoi e/o con una motilità estremamente ridotta. L’ICSI viene utilizzata anche in caso di spermatozoi crioconservati, eiaculazione retrograda e in tutti i casi di recupero chirurgico degli spermatozoi (TESE e MESA). Le fasi della ICSI sono identiche a quelle del trattamento FIVET, ad eccezione dell’inseminazione degli ovociti. Questa viene effettuata mediente l’iniezione di un unico spermatozoo all’interno del citoplasma dell’ovocita. L’iniezione viene realizzata con un l’ausilio di un microago e di un sofisticato microscopio, il micromanipolatore.
La ICSI può essere eseguita solo se l’ovocita ha completato la prima fase di maturazione nucleare ed espulso il primo globulo polare. Per questo motivo, a differenza della FIVET, prima dell’inseminazione è necessario rimuovere il Complesso Cumulo Ovocita, un cumulo di cellule di origine follicolare che circondano l’ovocita e non ne permettono la visione diretta.
AZH (Assisted Zona Hatching)
Ovociti ed embrioni nelle prime fasi di sviluppo sono circondati da un rivestimento acellulare, definito zona pellucida, costituito da glicoproteine, carboidrati e proteine zona pellucida–specifiche, la cui funzione si esplica sia durante i processi di fecondazione sia al termine degli stessi, quando impedisce la polispermia (penetrazione nell’ovocita da parte di altri spermatozoi), facilita il trasporto attraverso le tube degli ovociti fecondati e ne impedisce la dispersione dei blastomeri (cellule di divisione degli embrioni) così come il contatto con gli elementi cellulari che possono minarne l’integrità fino a quando non sia avvenuta la compattazione dei blastomeri.
Quando l’embrione raggiunge lo stato di blastocisti l’espansione della massa embrionale determina l’assottigliamento della zona pellucida, requisito fondamentale per l’interazione con l’endometrio e l’impianto dell’embrione.
Si osserva in vitro, tuttavia, come a volte questo processo non si compia correttamente per la presenza di una zona pellucida particolarmente spessa e di maggior consistenza.
La procedura di Assisted Zona Hatching consiste nel produrre, quando ritenuto necessario, una piccola apertura della zona pellucida negli embrioni subito prima del loro trasferimento nell’utero. In questo modo si favorisce la fuoriuscita della blastocisti dalla zona pellucida e il contatto diretto con l’utero materno.
Vitrificazione di ovociti ed embrioni
Una svolta importante nell’ambito della Medicina della riproduzione, in grado di modificare le strategie mediante le quali pratichiamo la fecondazione in vitro, deriva dalla possibilità di congelare, tecnicamente “crioconservare”, le cellule germinali (ovociti e spermatozoi) e gli embrioni che da essi derivano e utilizzarli in un secondo momento. Tra le varie tecniche di congelamento ad oggi impiegabili per la crioconservazione di gameti ed embrioni, la “vitrificazione” è quella che garantisce le maggiori percentuali di successo. La vitrificazione di una soluzione acquosa (i gameti e gli embrioni sono considerati soluzioni acquose) consiste nel raggiungimento dello stato solido in un periodo di tempo così breve da impedire la formazione dei “temutissimi” cristalli di ghiaccio all’interno della o delle cellule. Questa metodica di congelamento “ultrarapido” previene, dunque, l’insorgere dei potenziali danni a carico delle strutture cellulari (citoscheletro, membrane) propri della tecnica tradizionale.
Il primo grande cambiamento che deriva dalle considerazioni sopra-riportate consiste nella possibilità di crioconservare gli ovociti in giovane età, bloccando l’orologio biologico della cellula alla data del congelamento, consentendo alla donna di “posticipare” nel tempo eventuali tentativi di concepimento senza che le percentuali di successo dello stesso risultino inficiate dal “fattore età materna”.
Il secondo grande cambiamento riguarda, invece, la gestione del ciclo di concepimento assistito. La statistica secondo la quale sopravvivenza dei gameti e degli embrioni alla vitrificazione supera il 95 %, ha permesso di modificare la strategia terapeutica: è possibile, infatti, massimizzare le percentuali di successo globali di un singolo ciclo di trattamento trasferendo un numero minore di embrioni “a fresco” (minimizzando i rischi correlati all’insorgenza di gravidanze multiple) e crioconservando gli embrioni in eccesso. Gli embrioni vitrificati potranno essere quindi utilizzati in caso di esito negativo e, soprattutto, quando gli effetti dannosi dei farmaci impiegati per la stimolazione saranno stati eliminati dall’organismo (solitamente, già dal ciclo successivo).

Biopsia dell’embrione
La diagnosi genetica pre-impianto è la tecnica diagnostica più precoce, tra le indagini prenatali, finalizzata all’identificazione, negi embrioni prodotti durante una procedura di Procreazione Medicalmente Assistita (PMA), di patologie genetiche o cromosomiche, trasmesse da uno o da entrambi i genitori.
Le indicazioni a questa tecnica sono rappresentate da:
– coppie a rischio di trasmettere alla prole gravi malattie genetiche o al terazioni cromosomiche;
– coppie ad elevato rischio di produrre embrioni con un corredo cromosomico alterato non compatibile con la vita.
Nel primo caso la tecnica si definisce PGD, nel secondo PGS. Entrambe le metodiche sono precedute dalla fecondazione in vitro, seguita dalla biopsia degli embrioni così generati. La metodica più utilizzata fino a pochi anni fa prevedeva la biopsia del materiale da esaminare al terzo giorno di sviluppo embrionale, con il prelievo di una o due cellule (blastomeri) dall’embrione. Negli anni più recenti, l’ottimizzazione delle condizioni di coltura ha permesse il prelievo bioptico al quinto giorno di sviluppo embrionale, cioè allo stadio di blastocisti. Questo consente l’aspirazione di cellule dal trofoectoderma, in questo modo la massa delle cellule interne, che darà origine al feto nelle fasi di sviluppo successive, non è danneggiata, garantendo un trauma minore per l’embrione rispetto al prelievo in terza giornata. La biopsia viene effettuata praticando un foro nella zona pellucida, lo strato di protezione che riveste l’embrione, ed aspirando le cellule (circa 10 o 20) con una pipetta da biopsia o provocando una erniazione delle cellule del trofoectoderma all’esterno.
Prelievo chirurgico degli spermatozoi
In caso di azoospermia, ovvero assenza di spermatozoi nell’eiaculato, esistono diverse tecniche microchirurgiche di prelievo degli spermatozoi, di seguito schematizzate.
PESA (Aspirazione percutanea degli spermatozoi dall’epididimo) e MESA (Aspirazione microchirurgica degli spermatozoi dall’epididimo) sono tecniche che prevedono il prelievo degli spermatozoi attraverso aspirazione con micropipetta dai tubuli epididimali (che trasportano gli spermatozoi dal testicolo alle vie seminali) o con microchirurgia dal tessuto epididimale. In relazione al risultato dell’intervento, qualità e quantità dello sperma raccolto, il prelievo sarà effettuato unilateralmente o bilateralmente.
Non vi è alcuna complicanza di rilievo, se la tecnica è eseguita in maniera corretta. Un dolore di entità moderata può protrarsi fino a 12 ore dopo la procedura. Eventuali ematomi dello scroto tendono a scomparire entro 48 ore.
Il tasso di fallimento della PESA è del 20% circa; in questi casi si può ricorrere a metodiche di prelievo alternativo. Questa tecnica offre il vantaggio di non necessitare di anestesia, se non di una piccola infiltrazione locale, ma allo stesso tempo ha il limite nella difficoltà di identificare le aree per l’aspirazione.
La principale indicazione è rappresentata dall’azoospermia (assenza degli spermatozoi nel liquido seminale) causata da ostruzione delle vie seminali o da assenza congenita (agenesia dei deferenti) secondaria a malattie genetiche come la fibrosi cistica.
TESA (Aspirazione degli spermatozoi dal testicolo) e TESE (Prelievo bioptico testicolare) sono tecniche equivalenti alle precedenti, rispetto alle quali di differenziano dalla sede del prelievo che è testicolare e non epididimale.
Il prelievo chirurgico di tessuto testicolare mediante TESE, è attualmente la metodica più utilizzata. Può essere eseguita in regime di day surgery in anestesia locale, con o senza sedazione. La TESE viene preferita alla MESA quando l’assenza di spermatozoi nel liquido seminale è causata da una loro ridotta produzione da parte del testicolo.
Ognuna di queste tecnica può essere eseguita contestualmente al prelievo degli ovociti della partner o, qualora vi sia la possibilità concreta di un insufficiente o nullo recupero di spermatozoi, prima di procedere alla stimolazione dell’attività ovarica della partner.